製品設計から商用生産までの再生医療等製品CDMOサービスを提供
- 開発コンサルティング
-
- 開発計画の立案
- PMDA相談
- 臨床研究用製品・治験製剤・
再生医療等製品の製造 -
- 臨床研究用製品・治験製剤・再生医療等製品の製造
- 生産体制の構築・運用
- 品質検査
- 製品仕様の設計
-
- 原材料の品質規格・安全性の設定
- 製造工程の開発
- 規格の設定
- 輸送方法の構築
各種サービスは一覧からご確認ください
- CDMO サービスメニュー 一覧
-
研究開発コンサルティング、製法課題抽出、製品仕様設計支援など
カテゴリー メニュー概要 説明 1)研究開発コンサルティング 開発計画立案支援 お客様の技術シーズに適した開発計画を立案します。適切な試験項目や実施時期もご提案します。
経験豊富なコンサルタントがPMDA 相談の準備段階からお客様を支援します。
また、海外のお客様のニーズが高い日本の規制に対応できるよう支援します。PMDA相談支援 海外事業者向け日本薬事コンサルティング 2)製法課題抽出 出張製造技術診断 お客様の技術シーズを弊社技術者が実際に目で見て診断し、製法上の課題を抽出、解決できるようご提案します。 Co-trial(当社施設にて顧客とともに一連の工程を実施)による製造技術診断 3)製品仕様設計支援 原材料の品質規格・安全性設定支援 製品特性に応じた原材料を選定し、品質規格などに提案します。
生物由来の原材料については「生物由来原料基準」への適合性を確認します。製造工程開発支援 製品特性に応じ、ヒト組織から一定の品質基準を満たす製品を製造できるよう製造工程開発を支援します。 規格設定支援 品質・安全性の観点から、組織の受入れから製品出荷までの製造工程における、工程検査、検査項目および規格設定を支援します。 品質規格試験設定支援 輸送方法構築支援 製品特性に応じたパッケージや輸送に用いる容器を開発します。さらに、品質と安全性を担保する担保するための輸送システム構築を支援します。 安定性試験支援 品質・安全性を担保する安定性試験を支援します。 製造工程開発受託 製品特性に応じ、ヒト組織から一定の品質基準を満たす製品を製造できるよう製造工程開発を受託します。 製法変更に伴う同等性検証受託 製法の変更に伴い同等性を担保するための検証をおこないます。 4)非臨床サンプル製造受託 非臨床サンプル製造受託 動物を用いる非臨床試験で使用するサンプル製造を受託します。 生産体制の構築・運用受託 再生医療等製品はGCTP省令に則り、製品ごとに製造管理および品質管理を行う必要があります。お客様の製品特性に適した管理システムを構築し、運用します。 品質規格試験受託 規格設定した品質規格試験を受託します。 5)臨床研究用製品製造受託 特定細胞加工物製造受託 お客様からの手順書(SOP )を基に、技術移管をおこない、特定細胞加工物の製造を受託します。 生産体制の構築・運用受託 お客様の製品ごとの製品特性に適した管理システムを構築し、運用します。 品質規格試験受託 規格設定した品質規格試験を受託します。 6)製造工程改良受託 後期治験又は商用のための製造工程改良受託 製品仕様設計の際に開発した製造工程を後期治験や商用製造向けに改良します。 7)製造工程開発受託 後期治験又は商用のための製造工程開発受託 製品仕様設計の際に開発した製造工程を後期治験や商用製造向けに開発します。 製法変更に伴う同等性検証受託 製法の変更に伴い同等性を担保するための検証をおこないます。 8)治験製品製造受託 治験製品製造受託 治験製品の製造を受託します。 治験製品の生産体制構築・運用受託 再生医療等製品はGCTP省令に則り、製品ごとに製造管理および品質管理を行う必要があります。お客様の製品特性に適した管理システムを構築し、運用します。 品質規格試験受託 規格設定した品質規格試験を受託します。 組織・製品輸送体制構築支援 再生医療等製品は有効期限が限られ、厳密な温度管理を必要とするため、製品ごとに各医療機関への輸送システムを最適化する必要があります。当社と提携物流会社で構築した輸送システムにより、お客様の製品をご指定先までお届けします。 セルバンク作製・保管受託 他家細胞由来の製品などの製造に欠かせないセルバンクを作製し、微生物検査、特性解析試験などの品質検査を実施します。作製したセルバンクは、当社が構築した管理システムのもと、適切な温度で保管します。 9)申請対応業務の受託 申請用データ取得の受託 PMDA相談および行政機関に提出する書類・資料の作成などの業務を支援、受託します。 申請資料等の作成支援 適合性調査の対応 10)商用製品製造受託 技術移転サービス お客様が保有する技術、手順、経験およびそのほかの重要なデータを当社に移転するサービスをおこないます。 バリデーション実行サービス 目的とする製品を恒常的に製造できるよう科学的根拠、妥当性について、データを取って検証します。 承認製品の製造受託 承認されたお客様の製品の製造を受託します。 承認製品の品質規格試験受託 承認されたお客様の製品の品質規格試験を受託します。 GCTP省令に基づく生産体制構築・運営受託 再生医療等製品はGCTP省令に則り、製品ごとに製造管理および品質管理を行う必要があります。お客様の製品特性に適した管理システムを構築し、運用します。 承認製品の出荷・輸送受託 承認されたお客様の製品を当社製造工場からの出荷および輸送を受託します。 安定性試験受託 品質・安全性を担保する安定性試験を支援します。 11)商用製造工程改良受託 承認製品の製造工程改良受託 承認されたお客様の製品の製造工程に関する改良を受託します。 - TFBS Bioscience, Inc. で対応可能なベクター製造および受託試験一覧
-
薬理試験、毒性試験、セルバンク特性解析など
※業務提携先の同社がCRO 試験を実施いたします
※TFBS バイオサイエンス株式会社のページにリンクします。
カテゴリー サブカテゴリー 試験項目/内容 薬理試験 in vivo試験 動物種:ラット・マウス・モルモット・ハムスター 投与経路:
・静脈内・動脈内・頭蓋内・気管内・皮下・カスタマイズ・腹腔内・関節内・鼻腔内・脳内・経口・筋肉内疾患モデル: - ・呼吸器系(*慢性閉塞性肺疾患(COPD)*鼻炎*喘息)
- ・急性肝不全(ALF) l 炎症性腸疾患(IBD)
- ・急性/ 慢性腎臓病(AKD/CKD)
- ・糖尿病
- ・スキンケア(*美白効果 *保湿効果 *毛髪再生効果)
- ・心血管
- ・固形腫瘍
- ・カスタムモデル
毒性試験(安全性) 一般毒性試験 生体内分布試験(GLP/非GLP) 遺伝毒性試験 局所過敏症試験 腫瘍原性試験 パイロット毒性試験(非GLP) ピボタル毒性試験(GLP) 動物試験用バイオアナリシス 臨床観察 病理組織学(IHC、H&E) 細胞介在性解析 * 免疫アッセイ用初代細胞培養 血清分析 * セルベースプラットフォーム 中和抗体の滴定 * ELISAプラットフォーム セルバンク特性解析(哺乳動物) 同一性試験 核型分析 DNA フィンガープリント RAPD (ランダム増幅ポリモルフィックDNA) 純度試験 電子顕微鏡観察 無菌試験 マイコプラズマ試験 特異的ウイルス試験 ウイルス試験(in vivo / in vitro) レトロウイルス試験 マイコバクテリウム試験 安定性試験 塩基配列解析 遺伝的安定性試験 その他試験 造腫瘍性 発癌性 セルバンク特性解析(細菌・酵母) - 生菌数試験 API 20Eによる同定試験 バクテリオファージ試験 グラム染色 直接培養法 RAPD (ランダム増幅ポリモルフィックDNA) 抗生物質耐性試験 シーケンス解析 制限酵素マッピングとコピー数解析 発現コンストラクトの保持確認 ウイルスクリアランス試験 - - バルクロットリリース試験 - - 前臨床/ 臨床サンプル用カスタマイズアッセイ開発・分析 - - - 対応可能な再生医療等製品の品質試験一覧
-
開発初期の試験法の開発、細胞形態他の確認作業、保存安定性試験など
試験項目 試験内容 試験法開発 開発初期の試験法の開発 確認試験 細胞形態、外観・性状・不溶性異物試験、分化能(骨芽細胞、脂肪細胞、軟骨細胞) 感染性因子に関わる試験 無菌試験、エンドトキシン試験、マイコプラズマ否定試験、ヒトウイルス否定試験 安全性 細胞増殖解析 純度試験 製造工程由来不純物試験(細胞純度試験、ウシ胎児血清由来アルブミン残留試験)、免疫表現型(目的細胞、目的外細胞)、導入遺伝子コピー数 製造工程由来不純物 増殖性レトロウイルス、残存ウイルスベクター、ウシ血清アルブミン 一般試験 外観・性状・不溶性異物試験 含量試験 ウイルスコピー数試験、遺伝子導入細胞数、生存率試験 特性解析 遺伝子導入コピー数試験、細胞表面マーカー試験 生物活性または力価試験 細胞傷害活性、サイトカイン産生、遺伝子発現 保存安定性試験 長期保存試験、輸送時安定性試験、凍結融解後(使用時)安定性試験
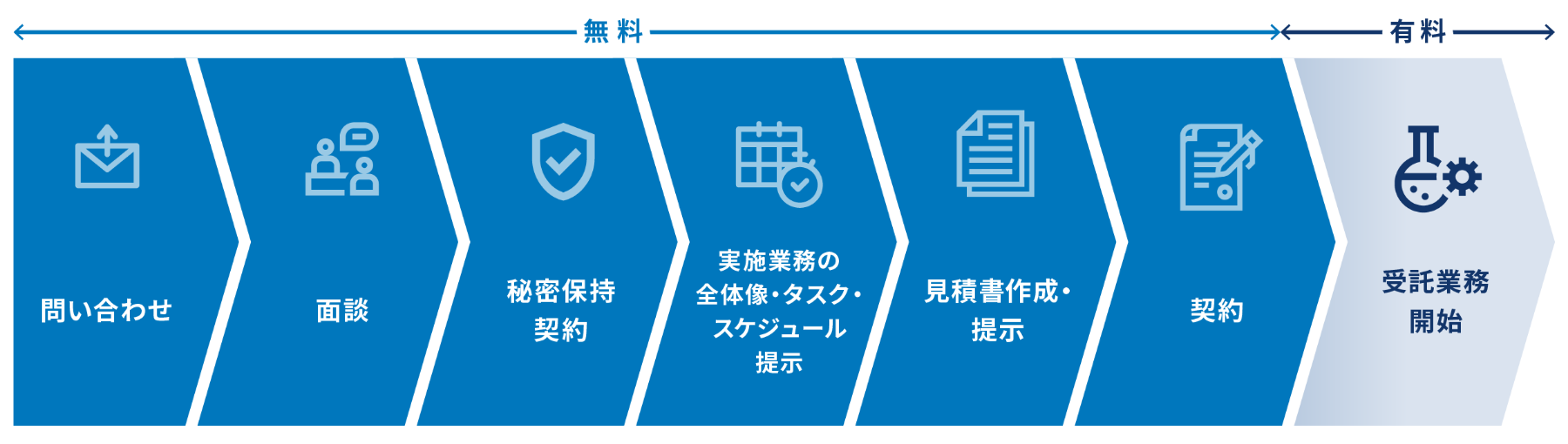
お問い合わせの流れ
お客様からお問い合わせをいただいてから、受託業務開始に至るまでの流れです。